Белки – это биологические гетерополимеры; синтезируются в живых организмах и выполняют в них важнейшие функции. В состав белков входят атомы углерода, кислорода, водорода, азота и иногда серы.
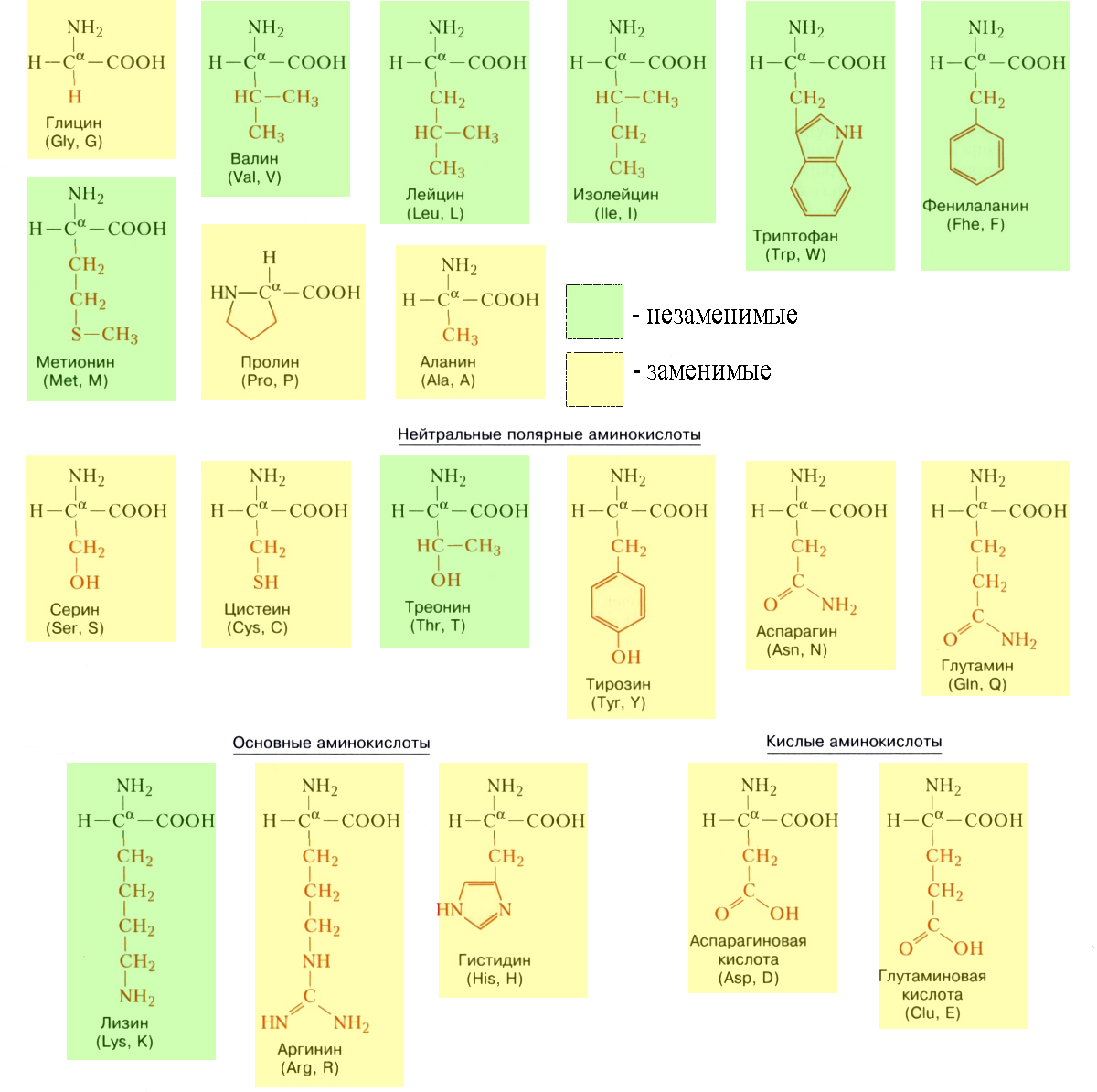
 Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал (по которому и различаются аминокислоты).
Мономеры белков – аминокислоты – вещества, имеющие в своем составе неизменяемые части аминогруппу NH2 и карбоксильную группу СООН и изменяемую часть – радикал (по которому и различаются аминокислоты).
Аминокислоты обладают свойствами и кислоты и основания (они амфотерны), поэтому могут соединяться друг с другом. Чередование разных аминокислот в разной последовательности позволяет получать огромное количество различных по структуре и функциям белков.
В белках встречается 20 видов различных аминокислот, некоторые из которых животные синтезировать не могут (отсюда – заменимые и незаменимые аминокислоты). Они получают их от растений, которые могут синтезировать все аминокислоты. Именно до аминокислот расщепляются белки в пищеварительных трактах животных. Из этих аминокислот, поступающих в клетки организма, строятся его новые белки.
Незаменимых аминокислот восемь: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Если они не поступают в организм, происходит значительное нарушение его функций. Запомнить незаменимые аминокислоты можно так:
Таблица аминокислот
Структура белковой молекулы – это ее аминокислотный состав, последовательность мономеров (аминокислот) и степень скрученности молекулы.
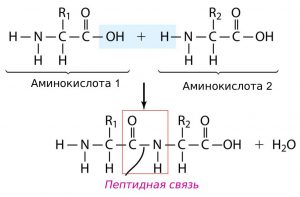 1. Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
1. Последовательность аминокислот в молекуле белка образует его первичную структуру. Она зависит от последовательности нуклеотидов в участке молекулы ДНК (гене), кодирующем данный белок. Соседние аминокислоты связаны пептидными связями, возникающими между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты.
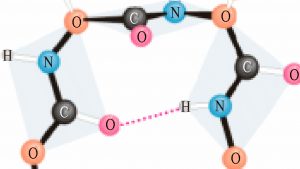 2. Сначала длинная молекула белка сворачивается и приобретает вид спирали. При этом образуется вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие витки спирали в свернутом положении.
2. Сначала длинная молекула белка сворачивается и приобретает вид спирали. При этом образуется вторичная структура белковой молекулы. Между СО и NH – группами аминокислотных остатков соседних витков спирали, возникают водородные связи, удерживающие витки спирали в свернутом положении.
3. Далее молекула белка сложной конфигурации в виде глобулы (шарика), приобретает третичную структуру. Прочность этой структуры обеспечивается гидрофобными, водородными, ионными и дисульфидными S-S связями, обеспечивающими сцепку между отдельными участками спирали.
 4. Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура белка может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
4. Некоторые белки имеют четвертичную структуру, образованную несколькими полипептидными цепями (третичными структурами). Четвертичная структура так же удерживается слабыми нековалентными связями – ионными, водородными, гидрофобными. Однако прочность этих связей невелика и структура белка может быть легко нарушена. При нагревании или обработке некоторыми химическими веществами белок подвергается денатурации и теряет свою биологическую активность.
Нарушение четвертичной, третичной и вторичной структур ↔обратимо↔.
Разрушение первичной структуры необратимо.
Белки имеют видовую специфичность: каждый вид организмов обладает белками, не встречающимися у других видов.